पदार्थ के भौतिक गुण (भौतिक और रासायनिक)
पदार्थ की विशेषता गुण वे रासायनिक या भौतिक गुण हैं जो एक पदार्थ को दूसरे से पहचानने या भेद करने में मदद कर सकते हैं। भौतिक गुण एक पदार्थ की विशेषताएं हैं जो इंद्रियों के साथ देखी जाती हैं। रासायनिक गुण वे विशेषताएँ हैं जो बताती हैं कि रासायनिक प्रतिक्रिया के दौरान एक पदार्थ एक पदार्थ से दूसरे में कैसे परिवर्तित होता है.
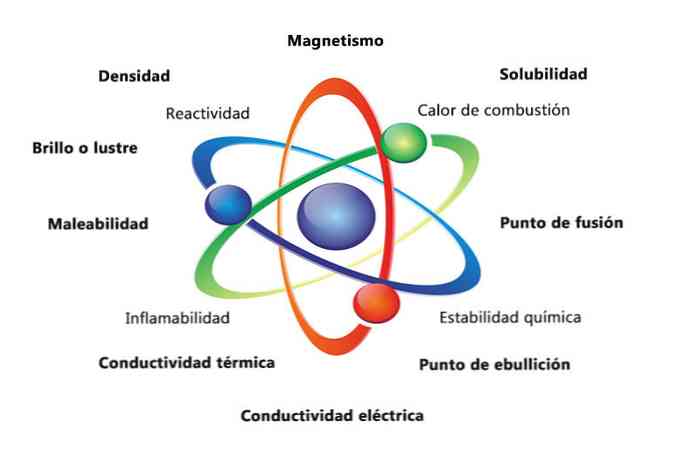
किसी पदार्थ के कुछ भौतिक गुण घनत्व, घुलनशीलता, गलनांक, रंग और द्रव्यमान होते हैं। सामग्री के रासायनिक गुणों में ज्वलनशीलता, एसिड और जंग के साथ प्रतिक्रियाशीलता शामिल है। किसी तत्व की पहचान करने में मदद करने वाले पदार्थों के गुणों के कुछ उदाहरण विभिन्न तत्वों की घनत्वों की तुलना करना है.
सोने जैसे तत्व का घनत्व 19.3 ग्राम प्रति घन सेंटीमीटर है, जबकि सल्फर का घनत्व 1.96 ग्राम प्रति घन सेंटीमीटर है। इसी तरह, पानी और आइसोप्रोपिल अल्कोहल जैसे पदार्थों के पिघलने के बिंदु अलग-अलग हैं.
पदार्थ के भौतिक गुण
पदार्थ के भौतिक गुण ऐसे गुण हैं जो पदार्थ की रासायनिक प्रकृति को बदलने के बिना मापा या मनाया जा सकता है। भौतिक गुणों के कुछ उदाहरण हैं:
- घनत्व: किसी वस्तु की मात्रा, द्रव्यमान को मात्रा से विभाजित करके गणना की जाती है.
- चुंबकत्व: चुंबक और चुंबकीय वस्तु के बीच आकर्षण बल.
- घुलनशीलता: किसी पदार्थ को किसी अन्य पदार्थ में कितनी अच्छी तरह से घोल सकते हैं, इसका माप.
- गलनांक: वह तापमान जिस पर कोई पदार्थ ठोस से तरल में बदलता है.
- क्वथनांक: वह तापमान जिस पर कोई पदार्थ तरल से गैस में बदलता है.
- विद्युत चालकता: एक माप है कि किसी पदार्थ के माध्यम से विद्युत धाराएं कितनी अच्छी तरह चलती हैं.
- तापीय चालकता: वह गति जिस पर कोई पदार्थ गर्मी स्थानांतरित करता है.
- मैलाबेलिटी: किसी पदार्थ की विभिन्न तरीकों से लुढ़कने या जमीन पर गिरने की क्षमता है.
- चमक या चमक: कितनी आसानी से वस्तु प्रकाश को दर्शाती है.
पदार्थ के रासायनिक गुण
रासायनिक गुण एक पदार्थ की क्षमता को विभिन्न गुणों के साथ एक नए पदार्थ में बदलने की क्षमता का वर्णन करते हैं। नीचे रासायनिक गुणों के कई उदाहरण दिए गए हैं:
- दहन की ऊष्मा: वह ऊर्जा है, जब एक यौगिक ऑक्सीजन के साथ एक पूर्ण दहन से गुजरता है.
- रासायनिक स्थिरता: संदर्भित करता है कि एक यौगिक पानी या हवा के साथ प्रतिक्रिया करेगा (रासायनिक रूप से स्थिर पदार्थ प्रतिक्रिया नहीं करेगा).
- ज्वलनशीलता: एक लौ के संपर्क में आने पर जलने की क्षमता.
- प्रतिक्रियाशीलता: किसी अन्य पदार्थ के साथ बातचीत करने और एक या एक से अधिक नए पदार्थ बनाने की क्षमता.
पदार्थ की भौतिक अवस्थाएँ
पदार्थ कुछ भी है जो एक स्थान पर कब्जा कर लेता है, जिसमें द्रव्यमान होता है और जिसे हमारी इंद्रियों द्वारा माना जा सकता है। पदार्थ को उसकी शारीरिक स्थिति के अनुसार वर्गीकृत किया जा सकता है: ठोस, तरल और गैसीय.
1- ठोस पदार्थ और उनके विशिष्ट गुण
सभी ठोस द्रव्यमान होते हैं, एक स्थान पर कब्जा करते हैं, एक निर्धारित मात्रा और आकार रखते हैं, अंतरिक्ष के माध्यम से पर्ची नहीं करते हैं और संकुचित नहीं हो सकते हैं या एक कठोर रूप हो सकते हैं। उदाहरण के रूप में हमारे पास हैं: लकड़ी, किताबें, स्पंज, धातु, पत्थर आदि।.
ठोस पदार्थों में, पदार्थ के छोटे कण एक साथ बहुत करीब होते हैं और एक दूसरे को स्पर्श करते हैं। कण एक साथ इतने करीब होते हैं कि वे ज्यादा हिल नहीं सकते, उनके बीच बहुत कम जगह होती है.
2- तरल पदार्थ और उनके विशिष्ट गुण
सभी तरल में द्रव्यमान होता है, एक स्थान पर कब्जा होता है, एक परिभाषित मात्रा होती है, लेकिन एक परिभाषित आकार नहीं (क्योंकि वे कंटेनर के अनुकूल हैं जहां वे हैं), वे बहुत छोटी डिग्री तक संकुचित हो सकते हैं और अंतरिक्ष के माध्यम से स्लाइड कर सकते हैं। उदाहरण के रूप में हमारे पास है: पानी, मिट्टी का तेल, आदि।.
तरल पदार्थों में, पदार्थ के छोटे कण एक दूसरे से थोड़ा आगे होते हैं, उनके बीच (ठोस पदार्थों की तुलना में) अधिक जगह होती है और वे एक दूसरे को स्पर्श नहीं करते हैं। इसलिए, कण अंतरिक्ष के बीच स्थानांतरित हो सकते हैं, धक्का दे सकते हैं और अन्य कणों से टकरा सकते हैं, लगातार बदलते दिशा.
3-गैसों और उनके विशिष्ट गुण
सभी गैसों में द्रव्यमान होता है, एक स्थान पर कब्जा होता है, एक परिभाषित मात्रा या आकार नहीं होता है, बहुत हद तक संकुचित हो सकता है और अंतरिक्ष में फैल सकता है। उदाहरण के रूप में हमारे पास हैं: हाइड्रोजन, ऑक्सीजन, नाइट्रोजन, कार्बन डाइऑक्साइड, भाप, आदि।.
गैसों में, पदार्थ के छोटे कण बहुत अलग होते हैं, उनके बीच (तरल पदार्थों की तुलना में) बहुत अधिक जगह होती है और वे एक दूसरे को स्पर्श नहीं करते हैं। कणों को आंदोलन की अधिकतम स्वतंत्रता है इसलिए वे लगातार बदलते दिशा में अन्य कणों के साथ धक्का और टकराते हैं.
पदार्थ की अवस्था में परिवर्तन
पदार्थ को ठोस अवस्था से तरल अवस्था में और इसके विपरीत, और तरल अवस्था से गैसीय अवस्था में और इसके विपरीत में परिवर्तित किया जा सकता है। यह रूपांतरण पदार्थ की स्थिति के परिवर्तन का नाम लेता है और तापमान में परिवर्तन से होता है:
विलयन
तापमान में वृद्धि के माध्यम से ठोस से तरल तक सामग्री की स्थिति में परिवर्तन। जब किसी ठोस पदार्थ को गर्म किया जाता है, तो ऊष्मा कणों को अधिक जोर से कंपन करने का कारण बनती है.
पिघलने के बिंदु पर पहुंचने पर, ठोस कणों में आकर्षण की ऊर्जावान ताकतों को दूर करने के लिए पर्याप्त गतिज ऊर्जा होती है जो उन्हें निश्चित स्थिति में रखती है, और वे तरल कणों के छोटे समूहों के निर्माण के लिए टूट जाती हैं।.
उबालना या वाष्पीकरण करना
तापमान के बढ़ने के माध्यम से तरल पदार्थ की स्थिति को गैसीय में बदलना। जब किसी तरल पदार्थ को गर्म किया जाता है, तो गर्मी कणों को और भी तेज कर देती है.
उबलते बिंदु तक पहुंचने पर, तरल कणों में आकर्षण की शक्तियों को दूर करने के लिए पर्याप्त गतिज ऊर्जा होती है जो उन्हें निश्चित पदों पर रखती है, और व्यक्तिगत गैसीय कणों में अलग हो जाती है।.
ठंड या जमना
तापमान में कमी से तरल पदार्थ की अवस्था को ठोस में बदलना। जब किसी तरल पदार्थ को ठंडा किया जाता है, तो इसके कण बहुत अधिक गतिज ऊर्जा खो देते हैं। हिमांक तक पहुँचने पर कण गति करना बंद कर देते हैं और ठोस स्थिति में स्थिर स्थिति में कंपन करते हैं.
द्रवीकरण या संघनन
तापमान में कमी के माध्यम से गैसीय पदार्थ की अवस्था को तरल में बदलना। जब किसी गैसीय पदार्थ को ठंडा किया जाता है, तो उसके कण बहुत अधिक गतिज ऊर्जा खो देते हैं जिसके कारण वे एक दूसरे को तरल कणों के रूप में आकर्षित करते हैं.
उच्च बनाने की क्रिया
कुछ सामग्री तरल अवस्था से गुजरे बिना, उनकी ठोस अवस्था से सीधे उनकी गैसीय अवस्था या इसके विपरीत बदल जाती हैं। जब इन ठोस पदार्थों को गर्म किया जाता है, तो उनके कण इतनी तेजी से बढ़ते हैं कि वे पूरी तरह से भाप या गैस बनाते हैं, और इसके विपरीत जब गैसीय से ठोस पदार्थ होता है।.
संदर्भ
- डी पोडेस्टा, एम। मामले के गुणों को समझना, 2 डी संस्करण। ग्रेट ब्रिटेन: टेलर एंड फ्रांसिस.
- गोयल ए। नई दिल्ली: डिस्कवरी पब्लिशिंग हाउस.
- मूर जे, स्टैनिट्स्की सी। आणविक विज्ञान, 5 वां संस्करण। स्टैमफोर्ड: सेंगेज लर्निंग.
- रामकृष्ण A. पदार्थ की प्रकृति, प्रथम संस्करण। नई दिल्ली: गोयल ब्रदर्स प्रकाशन.
- रेगर डी, गूड एस, बॉल डी। केमिस्ट्री। सिद्धांत और अभ्यास, तीसरा संस्करण। कनाडा: ब्रूक्स / कोल, सेंगेज लर्निंग.
- शापेरे डी। मैटर (भौतिकी)। से लिया गया: accessscience.com.
- सिंह एल, हमारे परिवेश में कौर एम। मैटर। भारत: एस। चंद स्कूल.


