Charakteristické vlastnosti hmoty (fyzikálne a chemické)
charakteristických vlastností hmoty sú to chemické alebo fyzikálne vlastnosti, ktoré môžu pomôcť identifikovať alebo odlíšiť jednu látku od inej. Fyzikálne vlastnosti sú vlastnosťami látky, ktorá je pozorovaná zmyslami. Chemické vlastnosti sú vlastnosti, ktoré opisujú, ako sa látka mení počas jednej chemickej reakcie z jednej látky na druhú.
Niektoré fyzikálne vlastnosti látky sú hustota, rozpustnosť, teplota topenia, farba a hmotnosť. Chemické vlastnosti materiálu zahŕňajú horľavosť, reaktivitu s kyselinami a koróziu. Niektoré príklady toho, ako môžu vlastnosti hmoty pomôcť identifikovať prvok, je porovnať hustoty rôznych prvkov.
Prvok ako zlato má hustotu 19,3 g / cm3, zatiaľ čo hustota síry je 1,96 g / cm3. Podobne teploty topenia látok, ako je voda a izopropylalkohol, sú rozdielne.
Fyzikálne vlastnosti hmoty
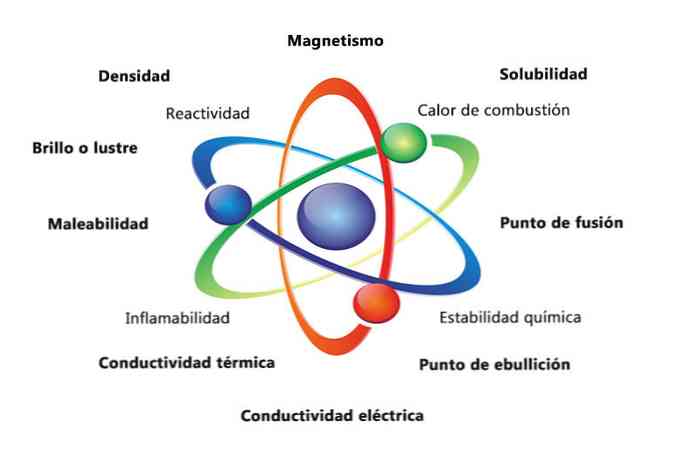
Fyzikálne vlastnosti hmoty sú vlastnosti, ktoré možno merať alebo pozorovať bez zmeny chemickej povahy látky. Niektoré príklady fyzikálnych vlastností sú:
- Hustota: množstvo hmoty, ktorá má predmet, sa vypočíta delením hmotnosti podľa objemu.
- Magnetizmus: sila príťažlivosti medzi magnetom a magnetickým objektom.
- Rozpustnosť: miera, do akej sa látka môže rozpustiť v inej látke.
- Teplota topenia: teplota, pri ktorej sa látka mení z tuhej na kvapalnú.
- Teplota varu: teplota, pri ktorej sa látka mení z kvapaliny na plyn.
- Elektrická vodivosť: je mierou, ako dobre sa elektrické prúdy pohybujú látkou.
- Tepelná vodivosť: rýchlosť, ktorou látka prenáša teplo.
- Zmáčavosť: je schopnosť látky, ktorá sa má zvinúť alebo rozomlieť rôznymi spôsobmi.
- Lesk alebo lesk: je to, ako ľahko objekt odráža svetlo.
Chemické vlastnosti látky
Chemické vlastnosti opisujú schopnosť látky premeniť sa na novú látku s rôznymi vlastnosťami. Nižšie je niekoľko príkladov chemických vlastností:
- Teplo spaľovania: je energia uvoľnená, keď zlúčenina podlieha úplnému spaľovaniu s kyslíkom.
- Chemická stabilita: označuje, či zlúčenina bude reagovať s vodou alebo vzduchom (chemicky stabilné látky nebudú reagovať).
- Horľavosť: schopnosť zlúčeniny horieť pri vystavení plameňu.
- Reaktivita: schopnosť interakcie s inou látkou a vytvorenie jednej alebo viacerých nových látok.
Fyzikálne stavy hmoty
Hmota je čokoľvek, čo zaberá priestor, ktorý má hmotnosť a ktorý môže byť vnímaný našimi zmyslami. Hmotu možno klasifikovať podľa jej fyzikálneho stavu: tuhé, kvapalné a plynné.
1 - Pevné látky a ich charakteristické vlastnosti
Všetky tuhé látky majú hmotnosť, zaberajú priestor, majú definovaný objem a tvar, neprekĺzajú sa priestorom a nemôžu byť stlačené alebo majú tuhú formu. Ako príklady máme: drevo, knihy, huby, kov, kamene atď..
V tuhých látkach sú malé častice hmoty veľmi blízko pri sebe a dotýkajú sa navzájom. Častice sú tak blízko pri sebe, že sa nemôžu veľmi pohybovať, medzi nimi je len veľmi málo priestoru.
2- Tekutiny a ich charakteristické vlastnosti
Všetky kvapaliny majú hmotnosť, zaberajú priestor, majú definovaný objem, ale nie definovaný tvar (pretože sa prispôsobujú nádobe tam, kde sú), môžu byť stlačené do veľmi malého stupňa a môžu kĺzať priestorom. Ako príklady máme: vodu, petrolej, olej atď..
V kvapalinách sú malé častice hmoty o niečo ďalej od seba, medzi nimi je viac priestoru (v porovnaní s pevnými látkami) a navzájom sa nedotýkajú. Preto sa častice môžu pohybovať medzi priestormi, tlačiť a kolidovať s inými časticami, neustále meniť smer.
3 - Plyny a ich charakteristické vlastnosti
Všetky plyny majú hmotnosť, zaberajú priestor, nemajú definovaný objem alebo tvar, môžu byť do značnej miery stlačené a môžu difundovať do priestoru. Ako príklady máme: vodík, kyslík, dusík, oxid uhličitý, paru atď..
V plynoch sú malé častice hmoty ďaleko od seba, medzi nimi je oveľa viac priestoru (v porovnaní s kvapalinami) a navzájom sa nedotýkajú. Častice majú maximálnu voľnosť pohybu, takže tlačia a kolidujú s inými časticami, ktoré neustále menia smer.
Zmeny stavu hmoty
Hmota môže byť premenená z tuhého do kvapalného stavu a naopak a z kvapalného stavu do plynného stavu a naopak. Táto konverzia má názov zmeny stavu veci a stáva sa zmenami teploty:
fúzie
Zmena stavu materiálu z pevnej látky na kvapalinu prostredníctvom zvýšenia teploty. Keď sa tuhá látka zahrieva, teplo spôsobuje, že častice silnejšie vibrujú.
Po dosiahnutí bodu topenia majú pevné častice dostatočnú kinetickú energiu, aby prekonali energetické sily príťažlivosti, ktoré ich držia v pevných polohách, a prasknú, aby vytvorili malé skupiny kvapalných častíc..
Var alebo odparovanie
Zmena stavu kvapalných látok na plynné pomocou zvýšenia teploty. Keď sa kvapalná látka zahrieva, teplo spôsobuje, že sa častice pohybujú ešte rýchlejšie.
Po dosiahnutí bodu varu majú kvapalné častice dostatočnú kinetickú energiu na prekonanie príťažlivých síl, ktoré ich držia v pevných polohách, a separujú sa na jednotlivé plynné častice..
Mrazenie alebo tuhnutie
Zmena stavu kvapalnej hmoty na tuhé látky pomocou poklesu teploty. Keď je tekutá látka ochladená, jej častice strácajú veľa kinetickej energie. Pri dosiahnutí bodu tuhnutia sa častice zastavia a vibrujú v pevnej polohe a stávajú sa pevnými časticami.
Skvapalňovanie alebo kondenzácia
Zmena stavu plynnej látky na kvapalinu prostredníctvom poklesu teploty. Keď sa plynná látka ochladzuje, jej častice strácajú množstvo kinetickej energie, ktorá ich spôsobuje, že sa navzájom priťahujú, aby sa stali kvapalnými časticami.
sublimácie
Niektoré materiály sa menia priamo zo svojho tuhého stavu do plynného stavu alebo naopak, bez toho, aby prechádzali kvapalným stavom. Keď sa tieto tuhé látky zahrejú, ich častice sa pohybujú tak rýchlo, že separujú úplne tvorbu pary alebo plynu, a naopak, keď sa proces uskutočňuje z plynnej na pevnú látku..
referencie
- De Podesta, M. Pochopenie vlastností hmoty, 2. vydanie. Veľká Británia: Taylor & Francis.
- Goel A. Štáty hmoty. New Delhi: Vydavateľstvo Discovery.
- Moore J, Stanitski C. Molekulárna veda, 5. vydanie. Stamford: Cengage učenie.
- Ramakrishna A. Povaha hmoty, 1. vydanie. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Chemistry. Princípy a prax, 3. vydanie. Kanada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fyzika). Zdroj: accessscience.com.
- Singh L, Kaur M. Matter v našom okolí. India: Škola S. Chand.


