De karakteristiska egenskaperna hos materia (fysisk och kemisk)
den karaktäristiska egenskaper hos materien De är kemiska eller fysikaliska egenskaper som kan hjälpa till att identifiera eller skilja ett ämne från en annan. Fysiska egenskaper är egenskaper hos ett ämne som observeras med sinnena. Kemiska egenskaper är egenskaper som beskriver hur ett ämne förändras från ett ämne till ett annat under en kemisk reaktion.
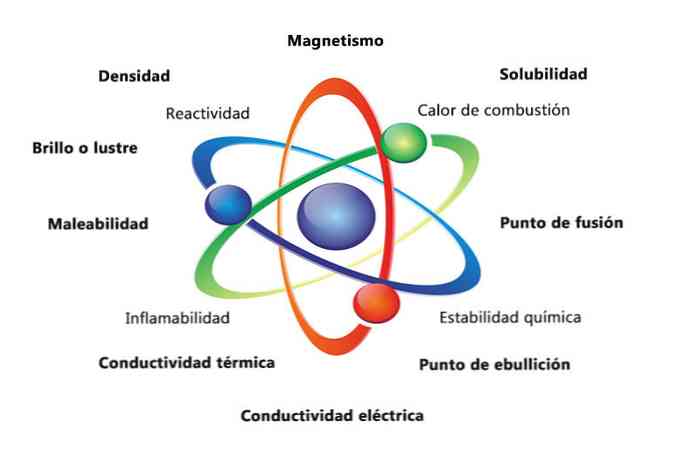
Vissa fysikaliska egenskaper hos ett ämne är densitet, löslighet, smältpunkt, färg och massa. Materialets kemiska egenskaper innefattar brandbarhet, reaktivitet med syror och korrosion. Några exempel på hur materiens egenskaper kan hjälpa till att identifiera ett element är att jämföra densiteter av olika element.
Ett element som guld har en densitet på 19,3 gram per kubikcentimeter medan densiteten av svavel är 1,96 gram per kubikcentimeter. På liknande sätt skiljer sig smältpunkterna av ämnen som vatten och isopropylalkohol.
Fysiska egenskaper hos materialet
Materiella fysikaliska egenskaper är egenskaper som kan mätas eller observeras utan att substansens kemiska natur förändras. Några exempel på fysikaliska egenskaper är:
- Densitet: Mängden materia som har ett objekt, beräknas genom att dela upp volymen.
- Magnetism: attraktionskraften mellan en magnet och ett magnetiskt objekt.
- Löslighet: Mätning av hur väl ett ämne kan lösas upp i en annan substans.
- Smältpunkt: temperatur vid vilken ett ämne förändras från fast till flytande.
- Kokpunkt: temperatur vid vilken ett ämne ändras från vätska till gas.
- Elektrisk ledningsförmåga: Det är ett mått på hur bra elströmmar rör sig genom en substans.
- Värmeledningsförmåga: Den hastighet vid vilken ett ämne överför värme.
- Smältbarhet: Är ett ämnes förmåga att rullas eller males på olika sätt.
- Glans eller glans: hur lätt objektet speglar ljus.
Kemiska egenskaper hos materialet
De kemiska egenskaperna beskriver ett ämnes förmåga att omvandla sig till en ny substans med olika egenskaper. Nedan finns flera exempel på kemiska egenskaper:
- Förbränningsvärme: Den energi som frigörs när en förening genomgår en fullständig förbränning med syre.
- Kemisk stabilitet: avser huruvida en förening kommer reagera med vatten eller luft (kemiskt stabila substanser reagerar inte).
- Brännbarhet: Föreningens förmåga att brinna vid exponering för en flamma.
- Reaktivitet: förmåga att interagera med ett annat ämne och bilda en eller flera nya ämnen.
Fysiska tillstånd av materia
Materia är något som upptar ett utrymme, som har massa och som kan uppfattas av våra sinnen. Ämnet kan klassificeras enligt dess fysiska tillstånd: fast, flytande och gasformig.
1-Solids och deras karakteristiska egenskaper
Alla fasta ämnen har massa, upptar ett utrymme, har en bestämd volym och form, inte glida genom rymden och kan inte komprimeras eller ha en styv form. Som exempel har vi: trä, böcker, svampar, metall, stenar etc..
I fasta ämnen är de små partiklarna mycket nära varandra och berör varandra. Partiklarna är så nära varandra att de inte kan flytta mycket, det finns mycket lite utrymme mellan dem.
2- Vätskor och deras karakteristiska egenskaper
Alla vätskor har massa, tar upp plats, men inte har en bestämd volym bestämd form (som de anpassar sig till behållaren där de är), kan komprimeras till en mycket liten omfattning och kan glida genom rymden. Som exempel har vi: vatten, fotogen, olja etc..
I vätskor, små partiklar av materia är lite längre ifrån varandra, att utrymmet mellan dem (i motsats till fast form) och inte i kontakt med varandra. Därför kan partiklar flytta mellan utrymmen, skjuta och kollidera med andra partiklar, ständigt byta riktning.
3- Gaser och deras karakteristiska egenskaper
Alla gaser har massa, upptar ett utrymme, har ingen bestämd volym eller form, kan komprimeras i stor utsträckning och kan diffundera i rymden. Som exempel har vi: väte, syre, kväve, koldioxid, ånga etc..
I gaser är de små partiklarna mycket längre ifrån varandra, det finns mycket mer utrymme mellan dem (jämfört med vätskor) och de rör inte varandra. Partiklarna har maximal rörelsefrihet så att de trycker och kolliderar med andra partiklar som ständigt ändrar riktningen.
Ändringar av materiens tillstånd
Materia kan omvandlas från fast till flytande tillstånd och vice versa tillstånd och från flytande till gasformigt tillstånd och vice versa. Denna omvandling tar namnet på statusändring och sker genom temperaturförändringar:
fusion
Materialförändring av materialet från fast till flytande medelst temperaturökningen. När en fast substans upphettas, orsakar värmen partiklarna att vibrera mer kraftigt.
Vid uppnående av smältpunkten för de fasta partiklarna har tillräcklig kinetisk energi för att övervinna de starka attraktionskrafter som håller dem i fasta lägen, och är uppdelade i mindre grupper av vätskepartiklar.
Kokning eller förångning
Förändring av tillståndet för vätskematerialet till gasformigt medelst temperaturökningen. När en flytande substans upphettas, gör värmen partiklarna rör sig ännu snabbare.
När kokpunkten har nåtts har vätskepartiklarna tillräcklig kinetisk energi för att övervinna de dragningskrafter som håller dem i fasta positioner och separeras i individuella gasformiga partiklar..
Frysning eller stelning
Förändring av tillståndet av vätskematerialet till fast material med hjälp av temperaturminskningen. När en flytande substans kyls, förlorar partiklarna mycket kinetisk energi. När man når fryspunkten slutar partiklarna att flytta och vibrera i fast position och blir fasta partiklar.
Likriktning eller kondensation
Förändring av tillståndet av gasformigt material till vätska med hjälp av temperaturnedgången. När en gasformig substans kyls, förlorar partiklarna mycket kinetisk energi vilket gör att de lockar varandra att bli flytande partiklar.
sublime
Vissa material byter direkt från sitt fasta tillstånd till gasformigt tillstånd eller vice versa, utan att gå igenom vätsketillståndet. När dessa fasta ämnen är uppvärmda, partiklarna rör sig så snabbt att separeras helt och bildar ånga eller gas, och vice versa när processen sker gasformig substans till fast.
referenser
- De Podesta, M. Förstå materiens egenskaper, 2: a upplagan. Storbritannien: Taylor & Francis.
- Goel A. Materiel. New Delhi: Discovery Publishing House.
- Moore J, Stanitski C. Molekylär vetenskap, 5: e upplagan. Stamford: Cengage Learning.
- Ramakrishna A. Materiellets natur, 1: a upplagan. New Delhi: Goyal Brothers Prakashan.
- Reger D, Goode S, Ball D. Chemistry. Principer och övning, 3: e upplagan. Kanada: Brooks / Cole, Cengage Learning.
- Shapere D. Matter (fysik). Hämtad från: accessscience.com.
- Singh L, Kaur M. Matter i vår omgivning. Indien: S. Chand School.


