Перейти к:
Прогностическое значение артериального давления в остром периоде ишемического инсульта полушарной локализации
https://doi.org/10.15829/1728-8800-2024-3886
EDN: DZQGMD
Аннотация
Цель. Изучить показатели артериального давления (АД) в остром периоде ишемического инсульта (ИИ) полушарной локализации, сопоставить с АД в группе с хронической сосудистой мозговой недостаточностью (ХСМН) и определить связь АД с тяжестью ИИ и восстановлением неврологических нарушений.
Материал и методы. Обследованы 235 больных с ИИ полушарной локализации (возраст 64±11 лет, женщин — 41,3%). Оценка АД проводилась 6 раз: анамнестически по результатам самоконтроля в последний месяц до инсульта, на этапе скорой медицинской помощи, в приемном отделении (ПО), в отделении реанимации и интенсивной терапии с помощью суточного мониторирования АД (СМАД), в неврологическом отделении (СМАД) и на 90 сут. ИИ. В группе с ХСМН (178 чел., возраст 62±13 лет, женщин — 46,1%) АД оценивалось 3 раза: анамнестически в последний месяц до плановой госпитализации, в ПО и в неврологическом отделении (СМАД).
Результаты. У больных с ИИ по сравнению с группой с ХСМН отмечалось более высокое систолическое (САД) и пульсовое (ПД) АД в последний месяц до госпитализации. Больные ИИ характеризовались повышенной вариабельностью АД в течение всего острого периода, несмотря на формальное достижение целевых показателей САД и диастолического АД к 9-10 сут. заболевания. САД ≥160 мм рт.ст. одновременно на этапе в скорой медицинской помощи, ПО и отделении реанимации и интенсивной терапии, а также ПД ≥60 мм рт.ст. и вариабельность САД ≥18 мм рт.ст. в 1-2 и в 9-10 сут. заболевания положительно коррелировали со шкалой NIHSS (National Institute of Health Stroke Scale) (r≥0,37, p≤0,0017) на 10 сут. и шкалой mRS (modified Rankin Scale) (r≥0,29, p≤0,006) на 90 сут.
Заключение. У больных с ИИ полушарной локализации по сравнению с группой с ХСМН отмечены более высокие САД и ПД в течение последнего месяца до развития инсульта. В остром периоде стойкое повышение САД и ПД и их вариабельность ассоциируются с более тяжелым инсультом и менее полным восстановлением, что должно учитываться при проведении/коррекции антигипертензивной терапии.
Ключевые слова
Для цитирования:
Гусев Е.И., Драпкина О.М., Мартынов М.Ю., Глухарева А.П., Юцкова Е.В. Прогностическое значение артериального давления в остром периоде ишемического инсульта полушарной локализации. Кардиоваскулярная терапия и профилактика. 2024;23(2):3886. https://doi.org/10.15829/1728-8800-2024-3886. EDN: DZQGMD
For citation:
Gusev E.I., Drapkina O.M., Martynov M.Yu., Glukhareva A.P., Yutskova E.V. Prognostic value of blood pressure in the acute period of hemispheric ischemic stroke. Cardiovascular Therapy and Prevention. 2024;23(2):3886. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3886. EDN: DZQGMD
Введение
Ишемический инсульт (ИИ) — одна из ведущих причин инвалидности и смерти взрослого населения. Артериальная гипертензия (АГ) является основным модифицируемым фактором риска ИИ [1][2].
В остром периоде ИИ повышение артериального давления (АД) наблюдается у 75-80% больных [3]. В этот период стойкое и значительное повышение АД увеличивает риск развития отека головного мозга, кровоизлияний и нарастания неврологических нарушений [4], что обусловливает важность его оптимальной коррекции [5]. В рекомендациях Американской ассоциации кардиологов и специалистов по инсульту указано, что в первые 5-7 сут. ИИ оптимальным является снижение АД на ~15% по сравнению с исходным [6]. Согласно рекомендациям Европейской организации по борьбе с инсультом [7] и результатам анализа многоцентровых исследований [8], при снижении АД также необходимо учитывать факт проведения/непроведения реперфузионной терапии.
В ряде исследований рассматривается связь между уровнем АД в первые дни церебрального инсульта (ЦИ) и функциональным исходом. Так, Kang J, et al. [9], Shi Z, et al. [10] на основании повторных разовых измерений АД в первые 72 ч ИИ отметили положительную корреляцию между систолическим (САД) и диастолическим (ДАД) АД и выраженностью инвалидизации по модифицированной шкале Рэнкина (mRS — modified Rankin Scale) через 3 и 12 мес. после заболевания. В исследовании Weiss A, et al. [11] было показано, что высокое САД при госпитализации коррелирует не только с худшим восстановлением по mRS к концу первой недели заболевания, но и с бóльшей летальностью в отдаленном периоде инсульта. По данным Vemmos KN, et al. [12] наблюдается U-образная связь между АД в первые часы ИИ и его неблагоприятным исходом через 1 и 12 мес. Keezer MR, et al. [13] отмечают, что среднее АД >130 мм рт.ст. и <90 мм рт.ст. с учетом тяжести инсульта коррелируют с худшим 10-суточным восстановлением по mRS.
Одним из значимых показателей АД является его вариабельность. В исследовании ASCOT-BPLA (Anglo-Scandinavian Cardiac Outcomes Trial — Blood Pressure Lowering Arm) [14] было установлено, что у пациентов с транзиторной ишемической атакой в анамнезе повышенная межвизитная вариабельность АД ассоциировалась c более чем 6-кратным увеличением риска развития ЦИ (отношение шансов (ОШ)=6,22, 95% доверительный интервал (ДИ): 4,16-9,29). Остроумова О. Д. и др. [15] на основании анализа ряда исследований отметили, что межвизитная и долгосрочная вариабельность САД является фактором риска развития сердечно-сосудистых и цереброваскулярных заболеваний. В первые сутки ЦИ повышенная вариабельность САД и ДАД рассматривается как неблагоприятный прогностический признак восстановления по mRS к 90 сут. заболевания [16][17].
Ещё одним показателем, изучаемым в качестве прогностического фактора при оценке риска развития и исхода ЦИ, является пульсовое давление (ПД). Liu FD, et al. [18] отмечают, что повышение ПД на 10 мм рт.ст. достоверно ассоциировано с увеличением риска развития ЦИ. По данным Park JH, et al. [19] ПД ≥54 мм рт.ст. сопровождается более чем 5-кратным увеличением риска повторного геморрагического инсульта. Повышенная вариабельность ПД в первые 72 ч ИИ расценивается как признак неблагоприятного исхода к 30 и 90 сут. заболевания [20].
Суточное мониторирование АД (СМАД) является наиболее точным методом оценки АД. СМАД позволяет изучить различные показатели АД [21][22] и оптимизировать антигипертензивную терапию [23]. Проведение СМАД в первые 24-48 ч ЦИ в отделениях реанимации и интенсивной терапии (ОРИТ) позволяет выявить изменения АД, которые не фиксируются при обычных 3-4 разовых измерениях [24]. В то же время, после перевода из ОРИТ СМАД проводится реже, а его результаты не всегда учитываются при проведении антигипертензивной терапии [25][26].
Необходимо отметить, что в первые 24-48 ч после ЦИ у большинства больных развивается вегетативная дисфункция [27], которая накладывает определенные ограничения на правильную интерпретацию АД и результатов СМАД [28]. В связи с этим, большее прогностическое значение может иметь оценка показателей СМАД после уменьшения вегетативной дисфункции и стабилизации состояния, что в большинстве случаев достигается к концу первой — середине второй недели ЦИ.
Целью настоящего исследования было изучение АД в последний месяц до развития ИИ полушарной локализации, его изменений в первые 10 сут. заболевания и оценка связи АД с тяжестью инсульта и восстановлением на 10 и 90 сут. заболевания.
Материал и методы
Дизайн исследования отражен на рисунке 1. Исходно на этапе скорой медицинской помощи (СМП) и приемного отделения (ПО) в основной группе было 257 пациентов. Диагноз ИИ был подтвержден компьютерной томографией/магнитно-резонансной томографией (КТ/МРТ) у 235 человек, которые были включены в анализ. Группу сравнения составили 178 пациентов с хронической сосудистой мозговой недостаточностью (ХСМН), без анамнестических и нейровизуализационных указаний на предшествующие ЦИ.

Рис. 1 Дизайн исследования.
Контрольные точки оценки АД, тяжести инсульта (NIHSS) и восстановления (mRS).
Примечание: * — количество больных,
† — по данным самоконтроля в течение последнего месяца до или на 90 сут. после ИИ.
АД — артериальное давление, ДОМ — в последний месяц до госпитализации,
ИИ — ишемический инсульт, НО — неврологическое отделение,
ОРИТ — отделение реанимации и интенсивной терапии,
ПО — приемное отделение, СМАД — суточное мониторирование АД,
СМП — скорая медицинская помощь,
ХСМН — хроническая сосудистая мозговая недостаточность,
mRS — modified Rankin Scale (модифицированная шкала Рэнкина),
NIHSS — National Institute of Health Stroke Scale
(шкала инсульта Национального института здоровья).
Критерии включения в исследование отражены на рисунке 2. В обеих группах для исключения системной ошибки при оценке АД обязательным критерием включения было наличие АГ в анамнезе и прием антигипертензивных препаратов. Антигипертензивная терапия включала ингибиторы ангиотензинпревращающего фермента, антагонисты рецепторов ангиотензина II, β-блокаторы и диуретики. Монотерапия в группе с ИИ проводилась у 87 (37,0%) больных, в группе с ХСМН — в 59 (33,1%) наблюдениях, в остальных случаях в обеих группах назначалась комбинированная терапия.
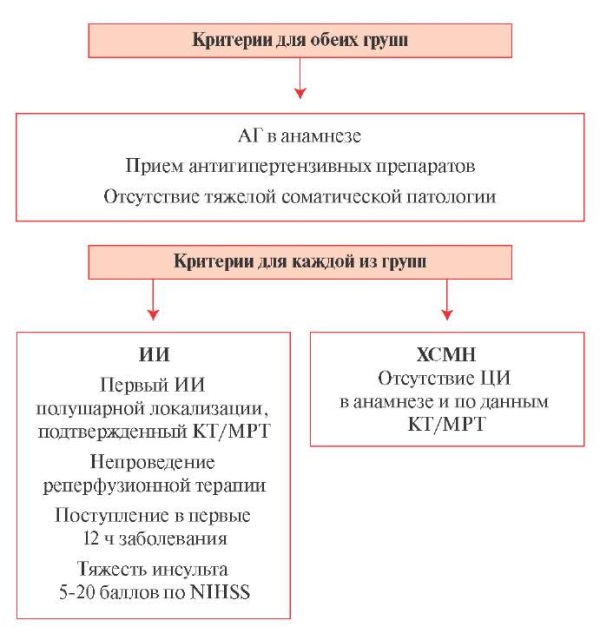
Рис. 2 Критерии включения в исследование.
Примечание: АГ — артериальная гипертензия,
ИИ — ишемический инсульт, КТ — компьютерная томография,
МРТ — магнитно-резонансная томография, ЦИ — церебральный инсульт,
ХСМН — хроническая сосудистая мозговая недостаточность,
NIHSS — National Institute of Health Stroke Scale
(шкала инсульта Национального института здоровья).
Исследование было одобрено Этическим комитетом ФГАОУ ВО "Российский национальный исследовательский медицинский университет имени Н. И. Пирогова" Минздрава России, протокол № 34/09-17 от 17.09.2017г. Все пациенты или их законные представители подписали информированное согласие о включении в исследование.
АД в группе с ИИ оценивали 6 раз (рисунок 1), в т.ч. на основании СМАД — 2 раза: на 1-2 сут. (Ме (медиана) до начала СМАД — 18 ч [ 15-23]) и 9-10 сут. (Ме до начала СМАД — 229 ч [ 219-235]). В группе с ХСМН АД оценивалось 3 раза, в т.ч. СМАД — однократно в неврологическом отделении (НО) на 5-7 сут. (рисунок 1). В домашних условиях до поступления и после выписки из стационара АД оценивалось на основании данных самоконтроля с использованием электронных или механических тонометров.
В стационаре для проведения СМАД использовали монитор BR-102 SCHILLER AG (Швейцария). Оценивались дневное и ночное САД, ДАД и среднее АД, вариабельность дневного, ночного и среднего АД, ПД, суточный индекс и степень снижения АД ночью. Перед СМАД проводилось 3 контрольных измерения АД с использованием механического тонометра. Манжета накладывалась на здоровую конечность. С 7:00 до 22:00 ч измерения АД проводились каждые 20 мин, с 23:00 до 07:00 ч — каждые 30 мин.
Результаты измерений АД с использованием механического тонометра и СМАД в группе с ИИ сопоставлялись в динамике между собой, а также с результатами СМАД в группе ХСМН.
Тяжесть ИИ оценивали по шкале инсульта Национального института здоровья США (NIHSS — National Institute of Health Stroke Scale) [29], а функциональный исход — по mRS [30].
Для статистического анализа использовали программы SPSS 22,0 и Epi info 7,0. Нормальность распределения данных оценивали по критериям Шапиро-Уилка или Колмогорова-Смирнова. Параметрические количественные данные представляли средним значением и среднеквадратичным отклонением (М±SD). Непараметрические количественные и ранговые переменные — Ме и интерквартильным размахом (Me [ Q25; Q75]). Сравнение средних в двух независимых выборках в зависимости от распределения результатов проводилось при помощи t-теста или U-критерия Манна-Уитни, в двух парных выборках — при помощи t-теста для связанных выборок или критерия Уилкоксона. Сравнение ≥3-х независимых/зависимых выборок проводили с применением одно/многофакторного или одно/многомерного дисперсионного анализа, соответственно. Корреляционный анализ выполнялся с определением коэффициента Пирсона или Спирмена. Для оценки различий в частоте бинарных признаков применяли таблицы сопряженности с расчетом ОШ и 95% ДИ. Для определения связи между уровнем АД в остром периоде ИИ и прогнозом восстановления по mRS на 90 сут. проводился расчет относительного риска (Relative Risk, RR) и его 95% границ. Результаты считались статистически значимыми при р<0,05.
Результаты
Обе группы не различались по демографическим показателям и факторам риска (таблица 1). Распределение больных по патогенетическому механизму и по тяжести ИИ соответствовало ранее проведенным исследованиям [31]. При сопоставлении размеров очагов с тяжестью ИИ (шкала NIHSS) отмечена ожидаемая корреляция: r=0,43, p=0,004. Также имелась ожидаемая связь между размерами очага и восстановлением по mRS (r=0,35, p=0,019).
Таблица 1
Демографическая и клиническая характеристика больных ИИ и ХСМН
Показатель |
ИИ (n=235) |
ХСМН (n=178) |
Возраст (лет), M±SD |
64±11 |
62±13 |
Пол (муж/жен), n (%) |
138/97 (58,7/41,3) |
96/82 (53,9/46,1) |
Рост (см), M±SD |
169±8 |
167±9 |
Вес (кг), M±SD |
79±14 |
77±17 |
ИМТ (кг/м²), M±SD |
28,7±4,2 |
27,4±5,8 |
ИМТ >25 кг/м², n (%) |
129 (54,9) |
92 (51,7) |
АГ, n (%) |
235 (100,0) |
178 (100,0) |
Прием антигипертензивных препаратов, n (%) |
235 (100,0) |
178 (100,0) |
Продолжительность АГ (лет), Me [ Q25; Q75] |
11 [ 6; 17] |
10 [ 7; 15] |
АГ меньше/больше 10 лет, n (%) |
120 (57,4)/89 (42,6) |
92(57,1)/69 (43,9) |
Ишемическая болезнь сердца, n (%) |
126 (53,6) |
83 (46,6) |
Инфаркт миокарда, n (%) |
45 (19,1) |
28 (15,7) |
Фибрилляция предсердий, n (%) |
41 (17,4) |
24 (13,4) |
Сахарный диабет, n (%) |
57 (24,2) |
45 (25,2) |
Глюкоза при поступлении (ммоль/л), M±SD |
6,1±2,7 |
5,7±1,9 |
Холестерин (ммоль/л), M±SD |
5,5±2,1 |
5,2±2,4 |
Примечание: АГ — артериальная гипертензия, ИИ — ишемический инсульт,
ИМТ — индекс массы тела, Ме — медиана,
ХСМН — хроническая сосудистая мозговая недостаточность.
В группе с ИИ за время пребывания в стационаре умерли 25 (10,6%) больных. Причинами смерти были тромбоэмболия легочной артерии или острый инфаркт миокарда — по 7 наблюдений, повторный инсульт — 6 пациентов, пневмония — 3 случая, расслаивающая аневризма брюшного отдела аорты и тромбоз мезентериальных сосудов — по 1 пациенту. Из стационара выписаны 210 пациентов с ИИ. К 90 сут. контакт был сохранен со 198 (94,3%) больными, в т.ч. очно в 127 (64,1%) случаях, а 71 (35,9%) случае при помощи телефонного интервью (рисунок 1).
АД в первые 10 сут. ИИ
САД и ДАД. Повышение САД в момент развития ИИ по сравнению с САД в последний месяц зафиксировано у 193 (81,2%) больных. Из этих больных повышение на ≤10% от исходных значений отмечено у 29 (15,0%), на 11-20% у 111 (57,5%) и на >20% у 53 (27,5%).
В СМП, ПО и ОРИТ все показатели АД были выше аналогичных значений в последний месяц до заболевания (ДОМ) (таблица 2). Показатели АД ДОМ положительно коррелировали (r≥0,26, p≤0,039) с АД, измеренным бригадой СМП, АД в ПО, АД в ОРИТ и АД в НО, т.е. чем выше было АД в последний месяц до развития ИИ, тем более высокие его показатели отмечались при госпитализации и в стационаре. Кроме этого, АД ДОМ в группе с ИИ было достоверно выше, чем АД ДОМ в группе с ХСМН (таблица 2).
Таблица 2
АД в группах с ИИ и ХСМН
Показатели АД, мм рт.ст. |
АД |
|||||||
ИИ |
ХСМН |
|||||||
ДОМ (235) |
В СМП (235) |
В ПО (235) |
В ОРИТ (229) |
В НО (210) |
На 90 сут. (198) |
ДОМ (178) |
В НО (178) |
|
САД |
144±9 |
173±12 |
169±11 |
163±12 |
142±12 |
140±10 |
135±9 |
134±7 |
ДАД |
86±6 |
95±8 |
93±9 |
92±9 |
87±8 |
87±8 |
82±5 |
84±6 |
max САД |
199±21 |
– |
– |
210±23 |
201±17 |
– |
185±18 |
183±16 |
max ДАД |
99±12 |
– |
– |
106±14 |
97±11 |
– |
96±10 |
95±9 |
ПД |
56±6 |
71±11 |
69±8 |
68±6 |
53±6 |
52±7 |
52±5 |
51±6 |
вар. САД |
– |
– |
– |
20±6 |
17±3 |
– |
– |
15±3 |
вар. ДАД |
– |
– |
– |
14±4 |
13±2 |
– |
– |
11±3 |
Примечание: АД — артериальное давление, вар. ДАД — вариабельность ДАД,
вар. САД — вариабельность САД, ДАД — диастолическое АД,
ДОМ — в последний месяц до госпитализации, ИИ — ишемический инсульт,
НО — неврологическое отделение,
ОРИТ — отделение реанимации и интенсивной терапии,
ПД — пульсовое давление, ПО — приемное отделение,
САД — систолическое АД, СМП — скорая медицинская помощь,
ХСМН — хроническая сосудистая мозговая недостаточность,
max ДАД — максимальные значения ДАД, max САД — максимальные значения САД.
К 9-10 сут. заболевания САД и ДАД снизились на 13±4 и 15±3%, соответственно по отношению к аналогичным показателям АД в ОРИТ (1-2 сут.) (таблица 2).
ПД. ПД в течение последнего месяца до развития ИИ (ПД ДОМ) было достоверно выше, чем в группе с ХСМН (ХСМН ДОМ) (таблица 2). В группе с ИИ ПД ДОМ >50 мм рт.ст. зарегистрировано в 60,7% случаев, а в группе с ХСМН — в 44,3% (р=0,012, ОШ=1,94, 95% ДИ: 1,29-2,92).
Развитие инсульта сопровождалось увеличением ПД; измеренное бригадой СМП, в ПО и ОРИТ ПД превышало ПД ДОМ (таблица 2) (t≥4,32, p≤0,0011). К 9-10 сут. ПД снизилось до 53±6 мм рт.ст. и было ниже, чем до развития инсульта (t=3,85, p=0,0097) (таблица 2). Снижение ПД к 9-10 сут. по сравнению с измеренным бригадой СМП, в ПО и ОРИТ составило ≥22,1%, а ПД ≤50 мм рт.ст. зарегистрировано у 137 (65,2%) пациентов. В то же время, несмотря на снижение ПД к 9-10 сут., оно оставалось выше, чем в группе с ХСМН (t=3,47, p=0,007) (таблица 2).
Вариабельность давления. Вариабельность САД и ДАД в 1-2 и 9-10 сут. в группе с ИИ достоверно превышала нормативные значения и показатели в группе ХСМН (таблица 2). При оценке в динамике отмечено уменьшение вариабельности САД и ДАД от 1-2 к 9-10 сут.: 15,0±3,5% и 7,2±3,1%, соответственно (t≥2,71, р≤0,017). Тем не менее, на 9-10 сут. вариабельность САД и ДАД у больных ИИ оставалась выше нормативных значений и показателей в группе с ХСМН (t≥6,29, р≤0,00091).
АД на 90 сут. ИИ
На 90 сут. отмечено дальнейшее снижение САД и ПД по сравнению с концом острого периода (9-10 сут.) ИИ, а также по сравнению с аналогичными показателями в последний месяц до развития инсульта. Снижение АД ДОМ → АД 90 сут. составило для САД 5,1 мм рт.ст. (95% ДИ: 4,3-5,9) и для ПД — 3,9 мм рт.ст. (95% ДИ: 3,2-4,7) (t>7,84, df=198, p=0,00053).
АД и тяжесть инсульта
САД. При анализе связи между САД в последний месяц до инсульта с его тяжестью установлено, что у пациентов с САД ДОМ ≥155 мм рт.ст. достоверно чаще (р=0,039) диагностировался тяжелый инсульт (NIHSS ≥16), чем у пациентов в САД ДОМ ≤145 мм рт.ст. Сохранение САД ≥160 мм рт.ст. одновременно в СМП и ПО также ассоциировалось с тяжелым ИИ: р=0,008, ОШ=1,56, 95% ДИ: 1,37-1,77. Кроме этого, сохранение САД ≥160 мм рт.ст. одновременно в трех точках (СМП+ПО+ОРИТ) позволяло прогнозировать худшую динамику восстановления неврологических нарушений по шкале NIHSS от 1-2 к 9-10 сут.: САД ≥160 мм рт.ст. — ∆ NIHSS1-10 — 2,8±0,5 балла и САД <160 мм рт.ст. — ∆ NIHSS1-10 — 3,5±0,4 балла (p=0,019).
ПД. ПД ДОМ и ПД ПО коррелировало с тяжестью ИИ по шкале NIHSS при поступлении и на 9-10 сут. (r≥0,31, p≤0,042). В подгруппе с ПД ДОМ ≥60 мм рт.ст. сумма баллов по NIHSS при поступлении составила 14,2±2,7 балла, а в подгруппе с ПД ДОМ ≤50 мм рт.ст. — 11,8±2,5 балла (t=4,27, p=0,001). В первой подгруппе было больше наблюдений с тяжелым инсультом, чем в подгруппе с ПД ДОМ ≤50 мм рт.ст.: 51,4 и 21,5%, соответственно (р=0,027). Иными словами, высокое ПД ДОМ в течение последнего месяца до развития инсульта позволяло предполагать более тяжелое течение ИИ.
Вариабельность давления. В подгруппе с вариабельностью САД в ОРИТ ≥18 мм рт.ст. сумма баллов по NIHSS составила 13,5±2,4, а в подгруппе с вариабельностью САД в ОРИТ ≤15 мм рт.ст. — 11,9±2,5 баллов (p=0,015). Кроме этого, в подгруппе с вариабельностью САД ≥18 мм рт.ст. было достоверно больше больных с NIHSS ≥16 баллов: р=0,002, ОШ=3,99, 95% ДИ: 1,51-10,59. При проведении логистического регрессионного анализа было установлено, что в группе с NIHSS ≥16 баллов каждый дополнительный балл по этой шкале соответствовал повышению вариабельности САД на 0,6 мм рт.ст. (95% ДИ: 0,4-1,0 мм рт.ст.) (p=0,007).
АД и восстановление к 10 и 90 сут.
САД. Наиболее значимая связь между САД и восстановлением по mRS отмечалась при разделении на подгруппы с САД ≤ и >160 мм рт.ст., фиксируемым одновременно бригадой СМП, в ПО и ОРИТ. Распределение по шкале mRS в этих подгруппах на 10 и 90 сут. отражено на рисунке 3. Уже к 10 сут. (mRS 10) между подгруппами формировались достоверные различия (χ²=18,39, df=5, р=0,017), которые сохранялись к 90 сут. (mRS 90): χ²=14,27, df=5, р=0,029. К 90 сут. в подгруппе с САД >160 мм рт.ст. RR неудовлетворительного восстановления (mRS >2) составил 1,68, 95% ДИ: 1,42-1,97, р=0,001 по сравнению с подгруппой с САД ≤160 мм рт.ст.

Рис. 3 Восстановление по mRS на 10 и 90 сут. заболевания
в подгруппах с САД > и ≤160 мм рт.ст.
Примечание: ОРИТ — отделение реанимации и интенсивной терапии,
ПО — приемное отделение, НО — неврологическое отделение,
САД — систолическое артериальное давление,
СМП — скорая медицинская помощь,
ХСМН — хроническая сосудистая мозговая недостаточность,
mRS — modified Rankin Scale (модифицированная шкала Рэнкина).
ПД. Сохранение ПД ≥60 мм рт.ст. одновременно в 3 точках (ДОМ+ПО+ОРИТ) ассоциировалось с худшим восстановлением. Сумма баллов по mRS на 10 и 90 сут. в этой подгруппе составила 2,8±1,0 и 2,3±1,1, в то время как в подгруппе с ПД ≤50 мм рт.ст. — 2,1±1,1 и 1,6±1,1 (t≥2,5, p≤0,032). Количество наблюдений с неудовлетворительным восстановлением (mRS ≥3) на 10 и 90 сут. заболевания также было больше в подгруппе с ПД ≥60 мм рт.ст.: 65,3 и 46,2% по сравнению с подгруппой с ПД ≤50 мм рт.ст.: 38,2 и 24,7% (р≤0,039). RR восстановления по mRS >2 баллов к 90 сут. в подгруппе с ПД ≥60 мм рт.ст. был выше, чем в подгруппе с ПД ≤50 мм рт.ст.: RR=1,61, 95% ДИ: 1,38-1,85 (р=0,0027).
Вариабельность давления. В подгруппе с вариабельностью САД в ОРИТ ≥18 мм рт.ст. неудовлетворительное восстановление к 10 сут. заболевания (mRS ≥3) отмечено у 52,6% больных, что было чаще, чем в группе с вариабельностью САД ≤15 мм рт.ст. — 19,5% больных (р=0,003). Различия между группами сохранялись и к 90 сут.: 31,5 и 10,9%, соответственно. В подгруппе с вариабельностью ≥18 мм рт.ст. по сравнению с подгруппой с вариабельностью ≤15 мм рт.ст. RR неудовлетворительного восстановления к 90 сут. был в ~1,5 раза выше: RR=1,47, 95% ДИ: 1,22-1,79 (р=0,001). Особенно неблагоприятным было сохранение вариабельности САД ≥18 мм рт.ст. одновременно в 1-2 и в 9-10 сут. Неудовлетворительное восстановление (mRS ≥3) к 10 и 90 сут. в этой подгруппе наблюдалось в 71,2 и в 59,4% случаях, а в подгруппе с нормализацией вариабельности САД к 9-10 сут.: 35,8 и 16,5% наблюдений, соответственно (р≤0,0023).
Обсуждение
В настоящее исследование были включены больные с ИИ полушарной локализации, т.к. ИИ в вертебрально-базилярной системе может сопровождаться относительно устойчивой вегетативной дисфункцией [32], что затрудняет правильную интерпретацию АД. Кроме этого, для исключения системной ошибки при оценке АД обязательным критерием включения в обеих группах было наличие АГ и прием антигипертензивных препаратов.
В результате исследования была установлена связь между показателями АД в последний месяц до инсульта и в первые 10 сут. заболевания с тяжестью ИИ по NIHSS, восстановлением по mRS к 10 и 90 сут. заболевания, а также с подтипом инсульта.
АД в последний месяц до развития инсульта. Несмотря на доказанность контроля АД в профилактике церебральных инсультов [33], практически отсутствуют исследования, в которых бы анализировалась связь между показателями АД в последний месяц до инсульта, его тяжестью и исходом. В настоящем исследовании было показано, что у больных с ИИ отмечались достоверно более высокие значения САД, ДАД и ПД по сравнению с больными с ХСМН в течение месяца, предшествовавшего развитию инсульта. При этом была установлена достоверная связь САД ДОМ ≥150 мм рт.ст. и ПД ДОМ >60 мм рт.ст. с тяжестью ИИ при поступлении и его исходом на 10 и 90 сут. заболевания. Полученные нами данные о роли оценки АД в домашних условиях совпадают с результатами Staplin N, et al. [34], которые показали, что амбулаторное, в первую очередь САД с большей степенью достоверности, чем АД в стационаре, позволяет прогнозировать развитие сердечно-сосудистых осложнений, в т.ч. со смертельным исходом.
САД и ДАД в первые 10 сут. и на 90 сут. после ИИ. У 193 (82,1%) больных ИИ развился на фоне повышения АД по сравнению с АД в последний месяц до развития инсульта. Аналогичные данные приводят Appleton JP, et al. [3].
Особенно значимой для прогноза оказалась динамика САД в 1-2 сут. заболевания: сохранение САД ≥160 мм рт.ст. одновременно в СМП, ПО и ОРИТ ассоциировалось с худшим восстановление по mRS к 10 и 90 сут., чем при снижении САД на этапе СМП → ОРИТ.
К 9-10 сут. снижение АД было отмечено у 79,4% больных с исходным повышением АД. Снижение САД и ДАД составило 13±4 и 15±3%, соответственно, а показатели САД и ДАД достигли рекомендуемых значений. Такое постепенное снижение АД рассматривается как наиболее оптимальное, уменьшающее вероятность гипоперфузии, которая может развиться при его более быстром снижении [6][7]. В то же время, несмотря на формальное достижение к 9-10 сут. рекомендуемых значений АД, максимальные показатели и вариабельность САД и ДАД превышали нормативные и аналогичные значения в группе ХСМН. Важно отметить, что проведение СМАД не только в ОРИТ, но и на 9-10 сут. позволило выявить колебания АД, не определяемые при обычных разовых измерениях, что является важным для принятия решения о выборе антигипертензивных препаратов в остром периоде ИИ.
На 90 сут. после ИИ отмечено дальнейшее снижение показателей АД, в т.ч. по сравнению с АД до инсульта. В то же время, необходимо отметить, что, несмотря на снижение, на 90 сут. показатели АД оставались выше, чем в группе с ХСМН.
ПД. По данным ряда исследований повышение ПД ассоциируется с увеличением риска развития инсульта [18], а также рассматривается как неблагоприятный прогностический фактор восстановления после него [20][35]. В настоящем исследовании ПД в последний месяц до инсульта было достоверно выше, чем в группе с ХСМН. Кроме этого, более высокое ПД ДОМ ассоциировалось с более тяжелым инсультом при поступлении. ПД также коррелировало с восстановлением по mRS к 10 и 90 сут. заболевания. При этом достоверная связь с худшим восстановлением отмечалась в подгруппе с ПД ≥60 мм рт.ст. в 1-2 и 9-10 сут. ИИ. Связь ПД с тяжестью и восстановлением после ИИ может быть обусловлена выраженными изменениями сосудистой системы и отражать поражение органов-мишеней [36]. По результатам многомерного регрессионного анализа [37] повышение ПД, увеличение скорости распространения пульсовой волны и амплификация ПД независимо от других факторов риска ассоциировано с большей толщиной комплекса интима-медиа в сонных артериях, более выраженным атеросклеротическим поражением периферических артерий, снижением скорости клубочковой фильтрации и поражением почек.
Вариабельность давления. Ряд исследований посвящен изучению роли вариабельности АД в развитии и течении ЦИ [16][17]. Нами установлена более высокая вариабельность САД и ДАД у больных с ИИ по сравнению с группой с ХСМН. Вариабельность также была связана с прогнозом восстановления, при этом наиболее значимая связь наблюдалась при сохранении повышенной вариабельности САД (≥18 мм рт.ст.) в ОРИТ + НО. Значение повышенной вариабельности в прогнозе восстановления после инсульта может быть обусловлено не только поражением сосудистой системы головного мозга [38], но и вовлечением других органов-мишеней со снижением переносимости физической нагрузки при реабилитации [39].
Ограничения исследования. Исследование имеет определенные ограничения. В домашних условиях до и после госпитализации измерение АД проводилось разными типами электронных и/или механических тонометров. Кроме этого, информация о показателях АД до и после госпитализации, полученная со слов пациента/родственника, могла быть приблизительной, т.к. не все пациенты вели дневники самоконтроля АД. Также необходимо отметить, что в исследование не включались больные с транзиторной ишемической атакой и больные с тяжелым и очень тяжелым инсультом (NIHSS >20 баллов).
Заключение
Таким образом, в последний месяц до развития инсульта и в его острейшем периоде отмечается повышение АД. Выраженность и динамика повышения АД позволяют прогнозировать тяжесть инсульта и степень восстановления. Проведение СМАД не только в 1-2 сут., но на 9-10 сут. заболевания после стабилизации состояния больного позволяет выявить повышенную вариабельность АД, что важно учитывать при проведении антигипертензивной терапии.
Отношения и деятельность: все авторы заявляют об отсутствии потенциального конфликта интересов, требующего раскрытия в данной статье.
Список литературы
1. Kikuya M, Hansen TW, Thijs L, et al. International database on ambulatory blood pressure monitoring in relation to cardiovascular outcomes investigators. Diagnostic thresholds for ambulatory blood pressure monitoring based on 10-year cardiovascular risk. Circulation. 2007;115(16):2145-52. doi:10.1161/CIRCULATIONAHA.106.662254.
2. Riis J, Nordestgaard BG, Jensen GB, et al. Secular trends in risk of stroke according to body mass index and blood pressure, 1976-2017. Neurology. 2019;93(14):e1397-407. doi:10.1212/WNL.0000000000008193.
3. Appleton JP, Sprig N, Bath PM. Blood pressure management in acute stroke. Stroke Vasc Neurol. 2016;1(2):72-82. doi:10.1136/svn-2016-000020.
4. de Havenon A, Bennett A, Stoddard GJ, et al. Increased blood pressure variability is associated with worse neurologic outcome in acute anterior circulation ischemic stroke. Stroke Res Treat. 2016;2016:7670161. doi:10.1155/2016/7670161.
5. Gąsecki D, Coca A, Cunha P, et al. Blood pressure in acute ischemic stroke: challenges in trial interpretation and clinical management: position of the ESH Working Group on Hypertension and the Brain. J Hypertens. 2018;36(6):1212-21. doi:10.1097/HJH.0000000000001704.
6. Powers WJ, Rabinstein AA, Ackerson T, et al. Guidelines for the early management of patients with acute ischemic stroke: 2019 update to the 2018 guidelines for the early management of acute ischemic stroke. Stroke. 2019;50:e344-418. doi:10.1161/STR.0000000000000211.
7. Berge E, Whiteley W, Audebert H, et al. European Stroke Organisation (ESO) guidelines on intravenous thrombolysis for acute ischaemic stroke. Eur Stroke J. 2021;6(1):I-LXII. doi:10.1177/2396987321989865.
8. Wang X, Song L, Yang J, et al; on behalf of the ENCHANTED Investigators. Interaction of blood pressure lowering and alteplase dose in acute ischemic stroke: results of the Enhanced Control of Hypertension and Thrombolysis Stroke Study. Cerebrovasc Dis. 2019;48(3-6):207-16. doi:10.1159/000504745.
9. Kang J, Ko Y, Park JH, et al. Effect of blood pressure on 3-month functional outcome in the subacute stage of ischemic stroke. Neurology. 2012;79(20):2018-24. doi:10.1212/WNL.0b013e3182749eb8.
10. Shi Z, Li ES, Zhong JS, et al. Predictive significance of day-to-day blood pressure variability in acute ischemic stroke for 12-month functional outcomes. Am J Hypertens. 2017;30(5):524-31. doi:10.1093/ajh/hpx005.
11. Weiss A, Beloosesky Y, Majadla R, et al. Blood pressure monitoring in the assessment of old patients with acute stroke. Int J Stroke. 2011;6(3):182-6. doi:10.1111/j.1747-4949.2011.00592.x.
12. Vemmos KN, Tsivgoulis G, Spengos K, et al. U-shaped relationship between mortality and admission blood pressure in patients with acute stroke. J Intern Med. 2004;255(2):257-65. doi:10.1046/j.1365-2796.2003.01291.x.
13. Keezer MR, Yu AY, Zhu B, et al. Blood pressure and antihypertensive therapy as predictors of early outcome in acute ischemic stroke. Cerebrovasc Dis. 2008;25(3):202-8. doi:10.1159/000113857.
14. Rothwell PM, Howard SC, Dolan E, et al. Prognostic significance of visit-to-visit variability, maximum systolic blood pressure, and episodic hypertension. Lancet. 2010;375(9718):895-905. doi:10.1016/S0140-6736(10)60308-X.
15. Остроумова О. Д., Борисова Е. В., Павлеева Е. Е. Вариабельность артериального давления. Межвизитная вариабельность артериального давления. Кардиология. 2017;57(11):68-75. doi:10.18087/cardio.2017.11.10056.
16. Minhas JS, Wang X, Lavados PM, et al. HeadPoST Investigators. Blood pressure variability and outcome in acute ischemic and hemorrhagic stroke: a post hoc analysis of the HeadPoST study. J Hum Hypertens. 2019;33(5):411-8. doi:10.1038/s41371-019-0193-z.
17. Liu W, Zhuang X, Zhang L. Prognostic value of blood pressure variability for patients with acute or subacute intracerebral hemorrhage: a meta-analysis of prospective studies. Front Neurol. 2021;12:606594. doi:10.3389/fneur.2021.606594.
18. Liu FD, Shen XL, Zhao R, et al. Pulse pressure as an independent predictor of stroke: a systematic review and a meta-analysis. Clin Res Cardiol. 2016;105(8):677-86. doi:10.1007/s00392-016-0972-2.
19. Park JH, Lee J, Kwon SU, et al. Elevated pulse pressure and recurrent hemorrhagic stroke risk in stroke with cerebral microbleeds or intracerebral hemorrhage. J Am Heart Assoc. 2022;11(3):e022317. doi:10.1161/JAHA.121.022317.
20. Kamieniarz-Mędrygał M, Kaźmierski R. Significance of pulse pressure variability in predicting functional outcome in acute ischemic stroke: a retrospective, single-center, observational cohort study. Sci Rep. 2023;13(1):3618. doi:10.1038/s41598-023-30648-2.
21. Staessen JA, Asmar R, De Buyzere M, et al. Participants of the 2001 Consensus Conference on Ambulatory Blood Pressure Monitoring. Task Force II: blood pressure measurement and cardiovascular outcome. Blood Press Monit. 2001;6(6):355-70. doi:10.1097/00126097-200112000-00016.
22. Котовская Ю. В., Кобалава Ж. Д. Суточное мониторирование артериального давления в клинической практике: не переоцениваем ли мы его значение? Артериальная гипертензия. 2004;10(1):5-12.
23. Patarroyo SX, Anderson C. Blood pressure lowering in acute phase of stroke: latest evidence and clinical implications. Ther Adv Chronic Dis. 2012;3(4):163-71. doi:10.1177/2040622312450183.
24. Kang J, Hong JH, Jang MU, et al. Change in blood pressure variability in patients with acute ischemic stroke and its effect on early neurologic outcome. PLoS One. 2017;12(12):e0189216. doi:10.1371/journal.pone.0189216.
25. Vemmos KN, Spengos K, Tsivgoulis G, et al. Factors influencing acute blood pressure values in stroke subtypes. J Hum Hypertens. 2004;18(4):253-9. doi:10.1038/sj.jhh.1001662.
26. Maida C, Tuttolomondo A, Di Raimondo D, et al. Management of blood pressure and heart rate in patients with acute stroke. Curr Pharm Des. 2017;23(31):4583-97. doi:10.2174/1381612823666170714162455.
27. Orlandi G, Fanucchi S, Strata G, et al. Transient autonomic nervous system dysfunction during hyperacute stroke. Acta Neurol Scand. 2000;102(5):317-21. doi:10.1034/j.1600-0404.2000.102005317.x.
28. Xiong L, Tian G, Leung H, et al. Autonomic dysfunction predicts clinical outcomes after acute ischemic stroke: a prospective observational study. Stroke. 2018;49(1):215-8. doi:10.1161/STROKEAHA.117.019312.
29. Kogan E, Twyman K, Heap J, et al. Assessing stroke severity using electronic health record data: a machine learning approach. BMC Med Inform Decis Mak. 2020;20(1):8. doi:10.1186/s12911-019-1010-x.
30. van Swieten JC, Koudstaal PJ, Visser MC, et al. Interobserver agreement for the assessment of handicap in stroke patients. Stroke. 1988;19(5):604-7. doi:10.1161/01.str.19.5.604.
31. McArdle PF, Kittner SJ, Ay H, et al; NINDS SiGN Study. Agreement between TOAST and CCS ischemic stroke classification: the NINDS SiGN study. Neurology. 2014;83(18):1653-60. doi:10.1212/WNL.0000000000000942.
32. Hong JM, Kim TJ, Shin DH, et al. Cardiovascular autonomic function in lateral medullary infarction. Neurol Sci. 2013;34(11):1963-9. doi:10.1007/s10072-013-1420-y.
33. Pistoia F, Sacco S, Degan D, et al. Hypertension and stroke: epidemiological aspects and clinical evaluation. High Blood Press Cardiovasc Prev. 2016;23(1):9-18. doi:10.1007/s40292-015-0115-2.
34. Staplin N, de la Sierra A, Ruilope LM, et al. Relationship between clinic and ambulatory blood pressure and mortality: an observational cohort study in 59 124 patients. Lancet. 2023;401(10393):2041-50. doi:10.1016/S0140-6736(23)00733-X.
35. Tien YT, Chang MH, Lee YS, et al. Pulse blood pressure correlates with late outcome in acute ischemic stroke without significant culprit artery stenosis. J Stroke Cerebrovasc Dis. 2016;25(5):1229-34. doi:10.1016/j.jstrokecerebrovasdis.2016.02.008.
36. García-Ortiz L, Gómez-Marcos MA, Martín-Moreiras J, et al. Pulse pressure and nocturnal fall in blood pressure are predictors of vascular, cardiac and renal target organ damage in hypertensive patients (LOD-RISK study). Blood Press Monit. 2009;14(4):145-51. doi:10.1097/MBP.0b013e32832e062f.
37. Bai B, Teliewubai J, Lu Y, et al. Comparison of pulse wave velocity and pulse pressure amplification in association with target organ damage in community-dwelling elderly: The Northern Shanghai Study. Hypertens Res. 2018;41(5):372-81. doi:10.1038/s41440-018-0027-3.
38. Rouch L, De Souto Barreto P, Hanon O, et al; MAPT/DSA Group. Visit-to-visit blood pressure variability and incident frailty in older adults. J Gerontol A Biol Sci Med Sci. 2021;76(8):1369-75. doi:10.1093/gerona/glab112.
39. Triantafyllidi H, Benas D, Schoinas A, et al. Hypertension-mediated organ damage regression associates with blood pressure variability improvement three years after successful treatment initiation in essential hypertension. J Clin Hypertens (Greenwich). 2021;23(6):1150-58. doi:10.1111/jch.14209.
Об авторах
Е. И. ГусевРоссия
Гусев Евгений Иванович — заведующий кафедрой неврологии, нейрохирургии и медицинской генетики.
Москва
О. М. Драпкина
Россия
Драпкина Оксана Михайловна — д.м.н., профессор, академик РАН, директор.
Москва
М. Ю. Мартынов
Россия
Мартынов Михаил Юрьевич — профессор кафедры неврологии, нейрохирургии и медицинской генетики РНИМУ им. Н.И. Пирогова МЗ РФ; первый заместитель генерального директора Федерального центра мозга и нейротехнологий ФМБА России, невролог консультант.
Москва
А. П. Глухарева
Россия
Глухарева Анастасия Павловна — ассистент кафедры неврологии, нейрохирургии и медицинской генетики.
Москва
Е. В. Юцкова
Россия
Юцкова Екатерина Валерьевна — заведующая 13 неврологическим отделением.
Москва
Дополнительные файлы
Что известно о предмете исследования?
- Артериальная гипертензия является одним из важнейших факторов риска развития ишемического инсульта.
Что добавляют результаты исследования?
- Показатели систолического и пульсового артериального давления (АД) в последний месяц до развития инсульта и их динамика в острейшем периоде позволяют прогнозировать тяжесть инсульта и функциональный исход.
- Проведение суточного мониторирования АД не только в 1-2 сут., но и на 9-10 сут. заболевания позволяет выявить повышенную вариабельность АД, что важно учитывать при проведении антигипертензивной терапии.
Рецензия
Для цитирования:
Гусев Е.И., Драпкина О.М., Мартынов М.Ю., Глухарева А.П., Юцкова Е.В. Прогностическое значение артериального давления в остром периоде ишемического инсульта полушарной локализации. Кардиоваскулярная терапия и профилактика. 2024;23(2):3886. https://doi.org/10.15829/1728-8800-2024-3886. EDN: DZQGMD
For citation:
Gusev E.I., Drapkina O.M., Martynov M.Yu., Glukhareva A.P., Yutskova E.V. Prognostic value of blood pressure in the acute period of hemispheric ischemic stroke. Cardiovascular Therapy and Prevention. 2024;23(2):3886. (In Russ.) https://doi.org/10.15829/1728-8800-2024-3886. EDN: DZQGMD





















































